Meldung vom: | Verfasser/in: Sebastian Hollstein
Zur Original-Meldung
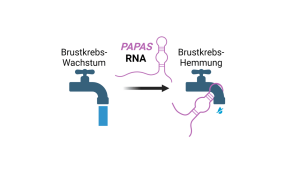
Schematische Darstellung der Tumorsuppressor-Funktion von PAPAS.
Abbildung: Holger Bierhoff mit BiorenderBrustkrebs ist die häufigste Krebserkrankung bei Frauen. Häufig geht die Entstehung des Mammakarzinoms von Epithelzellen in der Brustdrüse aus – genau den Zellen, die sich während und nach der Schwangerschaft auf die Milchbildung spezialisieren. Ein Team von Forschenden der Friedrich-Schiller-Universität Jena, der Universität im chinesischen Shenzhen sowie des Universitätsklinikums Jena hat diesen Prozess der Spezialisierung nun genauer unter die Lupe genommen und dabei einen molekularen Mechanismus entschlüsselt, der offenbar auch bei der Entstehung von Krebs eine wichtige Rolle spielt. Möglicherweise lassen sich auf der Grundlage dieser Forschungsergebnisse neue Diagnoseverfahren und Behandlungsmethoden von Brustkrebs entwickeln. Über ihre Arbeit berichten die Wissenschaftlerinnen und Wissenschaftler in der Fachzeitschrift „Cell Reports“.
RNA-Synthese an- und abschalten
Die Differenzierung von Zellen, also ihre Spezialisierung, ist wesentlicher Bestandteil eines Organismus' – nur durch sie können Zellen unterschiedliche Aufgaben übernehmen. Während der Laktogenese – also dem von Hormonen ausgelösten Prozess, der die Brustdrüsen zur Produktion von Muttermilch befähigt – vermehren sich zunächst die entsprechenden Zellen. Die hierfür notwendigen Proteine werden durch die Ribosomen hergestellt. Elementarer Baustein der Ribosomen ist die sogenannte ribosomale RNA, kurz rRNA. Werden mehr Proteine benötigt, steigt auch der Bedarf an rRNA – dementsprechend wird ihre Synthese im Zellkern hochgefahren. Am Ende der Laktogenese stellen die spezialisierten Zellen ihr Wachstum ein und drosseln die rRNA-Synthese wieder. Dieser Regulationsmechanismus passiert auf epigenetischer Ebene, das heißt, nicht etwa die DNA selbst verändert sich, sondern ihre Verpackung, wofür eine weitere Art von RNA zuständig ist.
„Wir haben herausgefunden, dass die sogenannte lange, nicht-codierende RNA PAPAS, die ich vor einigen Jahren entdeckt habe, auf die Verpackung der DNA einwirkt und die Produktion der rRNA verringert“, erklärt Dr. Holger Bierhoff, der das Projekt an der Universität Jena leitet. „Genau genommen beeinflusst sie den Zugriff auf die aktiven Bereiche der DNA und sorgt dafür, dass diese in RNA kopiert werden oder nicht. Wird viel rRNA benötigt, um viele Ribosomen – und damit viele Proteine – zu produzieren, wird die Herstellung von PAPAS verringert. Soll dieser Prozess gestoppt werden, dann wird PAPAS verstärkt gebildet.“
Außerdem fanden die Jenaer Expertinnen und Experten heraus, dass PAPAS nicht nur bei der Vermehrung der Zellen eine wichtige Rolle spielt, sondern auch bei der Spezialisierung. „Wir haben PAPAS durch Genmanipulation in der Zelle ausgeschaltet und konnten danach beobachten, dass die Entwicklung zu milchproduzierenden Zellen nicht mehr richtig funktionierte“, sagt Bierhoff.
Hohes PAPAS-Level – geringes Tumorwachstum
Auch in Krebszellen ist die rRNA-Synthese gesteigert, denn sie vermehren sich schnell und benötigen dafür viele Proteine – und entsprechend viele Ribosomen. „Deshalb haben wir uns gefragt, ob der von uns beobachtete Regulierungsmechanismus auch bei der Brustkrebsentstehung eine Rolle spielt. Die Antwort lautet eindeutig: ja“, erklärt der Jenaer Zellbiologe. „Als wir die PAPAS-Synthese verringerten und die Spezialisierung der Zellen ausschalteten, konnten wir beobachten, dass die Zellen zunehmend Eigenschaften von Krebszellen entwickelten.“ Im Gegensatz dazu zeigten die Forschenden sowohl in Zellkulturen als auch an Mäusen, dass ein hohes PAPAS-Level das Tumorwachstum – und auch die Ausbreitung von Metastasen – verringert.
Doch wie gelingt es der Krebszelle, die PAPAS-Produktion abzuschalten und somit die rRNA-Synthese anzukurbeln? „Auch dafür haben wir einen Mechanismus gefunden“, erklärt Holger Bierhoff. „Um PAPAS herzustellen braucht es ein molekulares Signal am Anfang des PAPAS-Gens. Diese Signalstruktur wird von bestimmten Proteinen reguliert, das heißt, diese Proteine können die Struktur abbauen oder blockieren. Wir haben beobachtet, dass die Produktion dieser Proteine in Brustkrebszellen besonders erhöht ist. Je aggressiver der Tumor, desto mehr von ihnen sind vorhanden.“
Jenaer Forschende entwickeln RNA-Therapie
Für Holger Bierhoff sind die Forschungsergebnisse in doppelter Hinsicht vielversprechend: „Zum einen sehen wir, dass PAPAS ein interessanter Marker sein kann, um die Aggressivität eines Brusttumors einzuschätzen. Diese Informationen lassen sich möglicherweise als diagnostisches Hilfsmittel nutzen“, sagt er. „Zum anderen arbeiten wir bereits daran, eine RNA-Therapie für die Krebsbehandlung zu entwickeln. Wir kennen den Mechanismus, wie PAPAS die rRNA Synthese reguliert, und wir wissen, welcher Bereich der RNA dafür notwendig ist. Die Idee ist nun, diesen künstlich herzustellen, verpackt in Nanopartikel in die Krebszellen einzubringen und so die Funktion der RNA PAPAS wiederherzustellen. So reduzieren wir die Synthese der rRNA, die der Krebs braucht, um zu wuchern.“ Dies sei ein ähnliches Verfahren wie bei den mRNA-Impfstoffen gegen die Covid-Erkrankung – nur dass man hier keine Protein-codierende, sondern eine regulatorische RNA verwende.
Original-Publikation:
S. Ren, F. Bai, V. Schnell, C. Stanko, M. Ritsch, T. Schenk, E. Barth, M. Marz, B. Wang, X.-H. Pei, H. Bierhoff: „PAPAS promotes differentiation of mammary epithelial cells and suppresses breast carcinogenesis", Cell Reports, 2024; https://doi.org/10.1016/j.celrep.2023.113644Externer Link